Позвоночно-спинномозговые травмы почти всегда приводят к выраженным двигательным нарушениям, что приводит к инвалидизации. Последствия спинальных травм всегда связаны с нарушением самостоятельного передвижения, а шансы на восстановление напрямую зависят от степени повреждения, методов реабилитации и дисциплины пациента. В связи с этим фактом поиск эффективных реабилитационных методик восстановления ходьбы является крайне необходимым. В статье будет рассмотрена методика функциональной электростимуляции (ФЭС) в движении для восстановления нарушенных движений нижних конечностей. Будет представлен обзор научных исследований, посвященных анализу эффективности ФЭС в ходьбе для пациентов с травматическим повреждением спинного мозга.
Была изучена научная литература за период 2010 – 2020 гг. в которой исследовалась система функциональной электростимуляции малоберцового нерва (ФЭС) для активизации дорсифлексоров с целью предотвращения свисания стопы (foot drop) при частичном повреждении спинного мозга (SCI). Одна из научных работ — это европейское исследование [29], другое мульти диагностическое, многонациональное исследование с участием пациентов из Германии, Канады и Японии [30] и еще одно рандомизированное контрольное исследование (RCT), проведенное в США [40]. Эти статьи документируют влияние ФЭС на нарушение походки после травматической болезни спинного мозга (ТБСМ).
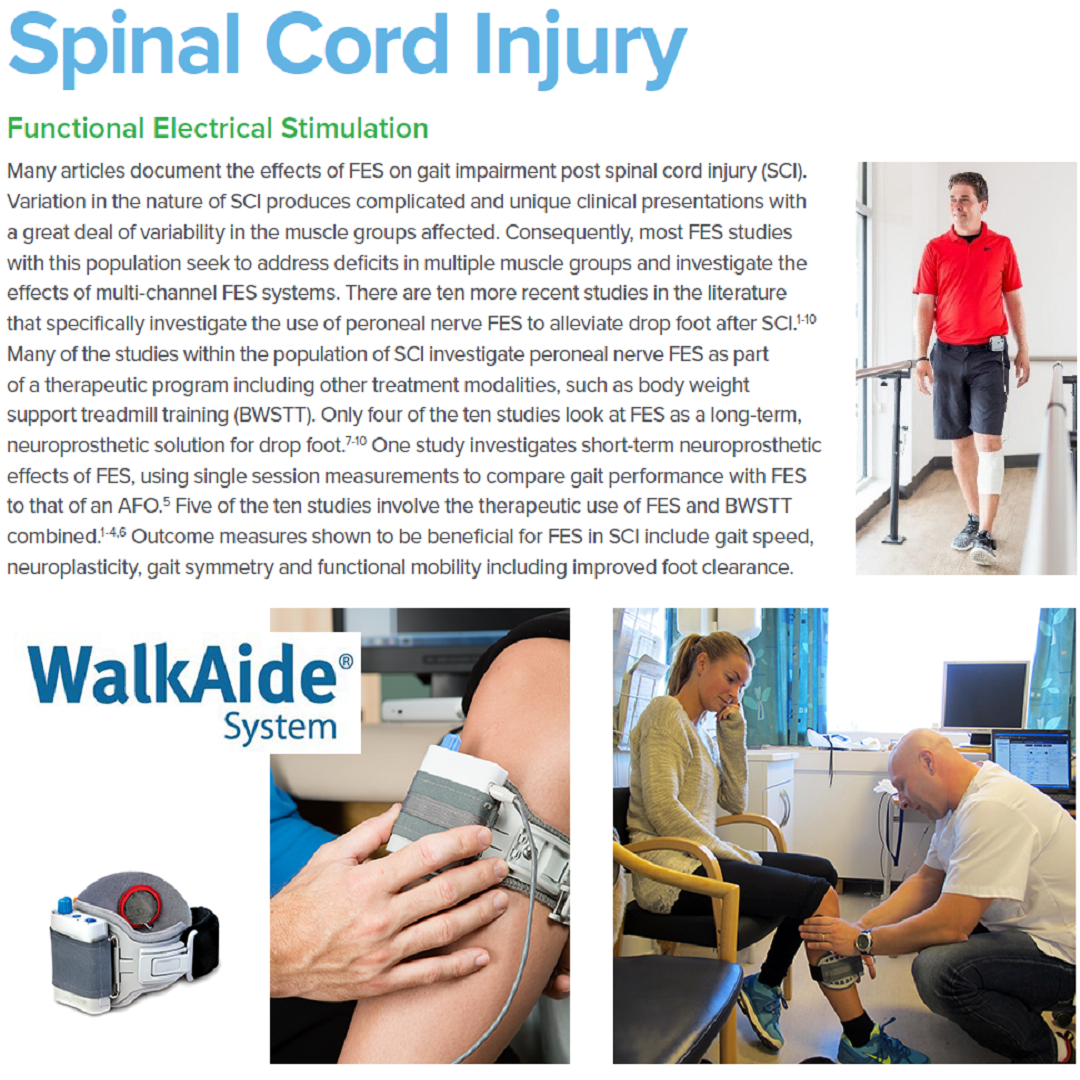
Разнообразие природы ТБСМ приводит к сложным и уникальным клиническим проявлениям с большой вариабельностью поражения различных мышечных групп. Поэтому большинство исследований по ФЭС применительно к данной патологии направлены на устранение дефицита в нескольких мышечных группах и изучение влияния многоканальных систем ФЭС. Но как известно ТБСМ обычно приводит к слабости не только передней большеберцовой мышцы, но и охватывает большое количество других групп мышц. Повреждение проводящих путей спинного мозга означает, что супраспинальные центры, которые запускают центральный генератор упорядоченной активности для управления локомоцией, имеют ограниченный доступ к спинномозговой локомоторной схеме, способствующей нормальному паттерну ходьбы [40].
ВЛИЯНИЕ ФЭС НА БИОМЕХАНИКУ ХОДЬБЫ
Такие параметры как скорость и симметрия походки являются наиболее часто измеряемые в исследованиях с использованием ФЭС перонеального нерва. В исследовании Street и соавторов изучалось влияние ФЭС на скорость ходьбы при стимуляции малоберцового нерва наряду со стимуляцией ягодичной седалищной мышцы и подколенного сухожилия, как это клинически показано. Исследование Field-Fote и соавторов включало в себя терапевтическое использование ФЭС к перонеальному нерву в сочетании с тренировкой на беговой дорожке с поддержкой массы тела (BWSTT) [40]. В многонациональном исследовании Stein и соавторов особое внимание уделялось электростимулятору ФЭС перонеального нерва для коррекции свисающей стопы среди пациентов не только со спинальной травмой, но и с ОНМК и РС [30]. Для обоснования группировки данных о ходьбе для испытуемых с ТБСМ, ОНМК и РС, были проверены различия между этими подгруппами с группой здоровых людей [30]. Группировка была одобрена с помощью статистической модели с проверкой уровня вариации различных групп данных (ANOVA: ФЭС × заболевание), которая не выявила никаких значимых различий ни в одном из переменных параметров ходьбы (скорость ходьбы, ходьба по прямой траектории, и индекс физиологических затрат PCI) между испытуемыми с ОНМК, ТСМ и РС в начале исследования и через 1, 2 и 3 месяцев наблюдения [30].
Полученные в исследованиях данные по улучшению сократительной функции дорсифлексоров с помощью ФЭС коррелируют с увеличением скорости ходьбы. В рандомизированном контролируемом исследовании EC Field-Fote отмечалось, что наиболее значительное увеличение скорости достигалось в группе ходьбы с аппаратом ФЭС из всех использованных в исследовании методик лечения [40]. Это исследование также показало, что группа с ФЭС также имела наиболее значительное увеличение пройденного расстояния во время теста 2-х минутной ходьбы [40]. Десять участников у которых были улучшения в период исследования, были повторно протестированы через 6 месяцев после ФЭС терапии; скорость ходьбы оказалась медленнее, чем по окончании терапии полгода назад, но оставалась быстрее, чем до проведения терапии [40].
Street и соавторы обнаружил существенное клинически значимое изменение в первоначальном ортопедическом эффекте (0,13 м/с, доверительный интервал CI 0,04-0,17, Р = 0,013), общем ортопедическом эффекте (0,11 м/с, доверительный интервал CI 0,04-0,18, Р = 0,017) и в терапевтическом эффекте (0,09 м/с, доверительный интервал CI 0,02-0,16, Р = 0,025) по скорости походки пациентов с ФЭС [29]. Street и соавторы пришли к выводу, что полученные результаты свидетельствуют о том, что ежедневное систематическое применение ФЭС может привести к клинически значимым изменениям скорости ходьбы, которые являются существенными для пациентов с неполной травмой спинного мозга [29]. В исследовании Stein и соавторы также рассматривали возможные долгосрочные терапевтические эффекты, в которых было отмечено сохраняющееся улучшение и после отключения устройства ФЭС. Выявлено, что через 12 месяцев у испытуемых с ТБСМ наблюдалось 28% увеличение скорости походки и без использования ФЭС [30].
Полученные данные по применению устройств ФЭС для улучшению функций дорсифлексоров имеют хорошие результаты по переносимости пациентами и коррелирует с количеством шагов, которые делает неврологический больной. В исследовании Штейн обнаружил, что количество часов использования ФЭС в день значительно увеличивалось с течением времени как для прогрессирующих, так и для не прогрессирующих неврологических заболеваний [30]. Испытуемые в группе в среднем носили прибор от 7,4 ± 0,5 ч/день до 9,6 ± 0,5 ч/день. Время использования и количество шагов в день было одинаковым для обеих групп и значительно увеличивалось с течением времени с 1842 ± 198 шагов/день до 2110 ± 204 шагов/день (среднее значение для обеих групп, время, Р = 0,019) [30]. Типичная длина большого шага для нашей популяции была близка к 1 м, испытуемые ходили с прибором около 2 км в день (P = 002) [30].
ФЭС ДЛЯ ВОССТАНОВЛЕНИЯ ДЕНЕРВИРОВАННЫХ МЫШЦ
Chandrasekaran и соавторами была проведена научная работа по влиянию электростимуляции на полностью денервированные мышцы в следствии травмы спинного мозга. С помощью методов доказательной медицины были получены научные данные, подтверждающие эффективное использование электростимуляции для восстановления денервированной мышцы после травмы спинного мозга. Была применена техника функционального нейро ортезирования с использованием продолжительной ширины импульса (LPWS) инновационной методикой стимуляции денервированных мышц [41].
Популяция пациентов с травмой спинного мозга ниже Т10 или травмой в районе конского хвоста характеризуется денервацией мышц, обширной атрофией мышц, инфильтрацией внутримышечного жира и образованием фиброзной ткани. Данные морфологического изменения могут привести к тому, что люди с ТБСМ будут подвергаться более высокому риску развития других заболеваний, таких как различные сердечно-сосудистые заболевания, диабет, ожирение и остеопороз. В настоящее время нет доступных реабилитационных мероприятий для восстановления мышц или мышечного объема у пациентов с ТБСМ с денервацией нижних мотонейронов.
Был проведен обзор последних исследований, подтверждающих использование электростимуляции для восстановления денервированной мышцы после ТБСМ. Техника стимулирования продолжительной шириной импульса (LPWS) является лидирующей методикой стимуляции полностью денервированных мышц. Основная цель ученых состоит в том, чтобы исследовать лучшие техники стимуляции, параметры стимуляции, и форму волн стимуляции для достижения наилучшего восстановления денервированной мышцы. Один из параметров стимуляции, длительность ширины импульса, должен быть в 100-1000 раз больше (от 10 мс до 100 мс), чем при работе в иннервируемыми мышцами, для того чтобы достичь желаемой возбудимости и сокращения. Использование электростимуляции с продолжительной шириной импульса (LPWS) на подопытных животных вызывало гипертрофию мышц. Результат исследований на животных доказал тот факт, что электростимуляция (ФЭС) в комбинации с физическими упражнениями и фармакологическим лечением, эффективна в увеличении относительной массы мышц, площади поперечного сечения мышц, количества миелинизированных регенерированных волокон и в восстановлении на определенном уровне мышечной функции. Подобные исследования на людях показали сходные результаты, подтвердив эффективность методики стимулирования продолжительной шириной импульса (LPWS) в увеличении площади поперечного сечения мышц, размера мышечных волокон и улучшения функции мышц. Таким образом, методика LPWS — это новый эффективный метод стимуляции денервированных мышц у людей с травмой спинного мозга. Успешные исследования с LPWS помогают перевести эту методику стимуляции на клинический уровень для дальнейшего использования в качестве реабилитационной интервенции после травм спинного мозга [41].
ЗАКЛЮЧЕНИЕ
Научная литература разнообразна по ФЭС, но лишь немногие исследования изучают отдельно влияние нейроортеза ФЭС перонеального нерва применительно к пациентам после ТБСМ. Однако те результаты, которые в наличии, обеспечивают значительную поддержку по эффективности применения ФЭС при свисающей стопе. Тот факт, что одноканальная система ФЭС дает такие положительные результаты, свидетельствует о невероятной эффективности нейро-ортезирования в восстановлении двигательной функций и обеспечении клинически значимого долгосрочного терапевтического эффекта по скорости ходьбы у пациентов с неполной травмой спинного мозга [29].
Анализ данных исследований статьей 2010-2020 годов, дополненных ранее представленными исследованиями, позволяет предположить, что нейро-ортезирование ФЭС для улучшения функций дорсифлексоров является эффективным инструментом для лечения парезов при неполном повреждении спинного мозга.
Библиография.
1. Ghedira M, Albertsen I, Mardale V, Gracies J, Bayle N, Hutin, E. Wireless, accelerometry-triggered peroneal nerve stimulation in spastic paraparesis: A randomized, controlled pilot. Official Journal of RESNA. 2017; 29(2): 99-105.
2. Morone G, Fusco A, Di Capua P, Coiro P, and Pratesi L. Walking Training with Foot Drop Stimulator Controlled by a Tilt Sensor to Improve Walking Outcomes: A Randomized Controlled Pilot Study in Patients with Stroke in Subacute Phase. Stroke Res Treat 2012; 2012: 523-564.
3. Miller L, Rafferty D, Paul L, Mattison P. A comparison of the orthotic effect of the Odstock Dropped Foot Stimulator and the WalkAide functional electrical stimulation systems on energy cost and speed of walking in Multiple Sclerosis. Disabil Rehabil Assist Technol. 2014 Mar 17. [Epub ahead of print]
4. Prenton S, Hollands K, Kenney L. Functional electrical stimulation versus ankle foot orthoses for foot-drop: a meta-analysis of orthotic effects. J Rehbil Med2016; 48: 646-656
5. Barrett C, Taylor P. The effects of the odstock drop foot stimulator on perceived quality of life for people with stroke and multiple sclerosis. Neuromodulation. 2010 Jan;13(1):58-64. 2008;87(1): 4-13.
6. Bulley C, Shiels J, Wilkie K, Salisbury L. User experiences, preferences and choices relating to functional electrical stimulation and ankle foot orthoses for foot-drop after stroke. Physiotherapy. 2011 Sep;97(3):226-33.
7. Dujovic S, Malesevic J, Malesevic N, Vidakovik AS, Bijelic G, Keller T, Konstantinovic L. Novel multi-pad functional electrical stimulation in stroke patients: A single-double blind randomized study.Neuro Rehabilitation. 2017; 41(4):791-800.
8. Shiels J, Wilkie K, Bulley C, Smith S and Salisbury L. A mixed methods service evaluation of a pilot functional electrical stimulation clinic for the correction of dropped foot in patients with chronic stroke. Primary Health Care Research & Development 2011; 12: 187–199
9. Street T, Swain I, Taylor P. Training and orthotic effects related to functional electrical stimulation of the peroneal nerve in stroke. J Rehabil Medicine 2017; 49:1-7 [Epub ahead of print].
10. Taylor P, Humphreys L, Swain I. The long-term cost- effectiveness of the use of Functional Electrical Stimulation for the correction of dropped foot due to upper motor neuron lesion. J Rehabil Med 2013;45(2):154-60.
11. Van Swigchem R, van Duijnhoven, HJR, den Boer J, Geurts AC, Weerdesteyn V. Effect of Peroneal Electrical Stimulation Versus an Ankle-Foot Orthosis on Obstacle Avoidance Ability in People with Stroke- Related Foot Drop. Phys Ther 2012;3(92):398-406.
12. Van Swigchem R, Vioothuis J, den Boer J, Weerdesteyn V, Geurts ACH. Is transcutaneous Peroneal stimulation beneficial to patients with chronic stroke using an ankle-foot orthosis? A within subjects study of patients’ satisfaction, walking speed and physical activity level. J Rehabil Med 2010;42:117-121.
13. Van Swigchem R, Weerdesteyn V, van Duijnhoven HJ, den Boer J, Beems T, Geurts AC. Near-Normal Gait Pattern with Peroneal Electrical Stimulation as a Neuroprosthesis in the Chronic Phase of Stroke: A Case Report. PM R 2011;92:320-324.
14. Wilkie KM, Shiels JE, Bulley C, Salisbury LG. "Functional electrical stimulation (FES) impacted on important aspects of my life": a qualitative exploration of chronic stroke patients' and carers' perceptions of FES in the management of dropped foot. Physiother Theory Pract. 2012 Jan;28(1):1-9.
15.Wilkinson IA, Burridge J, Strike P, Taylor P. A randomized controlled trial of integrated electrical stimulation and physiotherapy to improve mobility for people less than 6 months post stroke. Disabil Rehabil Assist Technol. 2014 May 14:1-7. [Epub ahead of print]
16. Gervasoni E, Parelli R, Uszynski M, Crippa A, Marzegan A, Montesano A, Cattaneo D. Effects of functional electrical stimulation on reducing falls and improving gait parameters in multiple sclerosis and stroke. PMR. 2017 Apr; 9(4):339-347.
17.Bulley C, Mercer TH, Hooper JE, Cowan P, Scott S, van der Linden ML. Experiences of functional electrical stimulation (FES) and ankle foot orthoses (AFOs) for foot-drop in people with multiple sclerosis. Disabil Rehabil Assist Technol. 2014 May 6. [Epub ahead of print]
18. Esnouf JE, Taylor PN, Mann GE, Barrett CL. Impact on activities of daily living using a functional electrical stimulation device to improve dropped foot in people with multiple sclerosis, measured by the Canadian Occupational Performance measure. Multiple Sclerosis 2010;16(9): 1141-1147.
19. Miller L, McFadyen A, Lord AC, Hunter R, Paul L, Rafferty D, Bowers R, Mattison P. Functional electrical stimulation for foot drop in multiple sclerosis: A systematic review and meta-analysis of the effect on gait speed. Arch Phys Med Rehabil. 2017 jul; 98(7):1435-1452.
20. Scott SM, van der Linden ML, Hooper JE, Cowan P, Mercer TH. Quantification of gait kinematics and walking ability of people with multiple sclerosis who are new users of functional electrical stimulation. J Rehabil Med. 2013;45(4):364-9.
21.Street T, Taylor P, Swain I. Effectiveness of functional electrical stimulation on walking speed, functional category, and clinically meaningful changes for patients with multiple sclerosis. Arch Phys Med Rehabil 2015 Apr; 96(4):667-72.
22. Taylor P, Barrett C, Mann G, Wareham W. A pilot randomized trial to investigate the effect of functional electrical stimulation and exercise on the quality of gait of people with secondary progressive MS. 3rd Annual Conference of the International Functional Electrical Stimulation Society (UK and Ireland Chapter), Birmingham, UK 2012.
23. Taylor P, Barrett C, Mann G, Wareham W, Swain I. A Feasibility Study to Investigate the Effect of Functional Electrical Stimulation and Physiotherapy Exercise on the Quality of Gait of People With Multiple Sclerosis. Neuromodulation. 2014 Jan;17(1):75-84.
24. van der Linden ML, Scott SM, Hooper JE, Cowan P, Mercer TH. Gait kinematics of people with Multiple Sclerosis and the acute application of Functional Electrical Stimulation. Gait Posture. 2014 Apr; 39(4):1092-6. doi: 10.1016/j.gaitpost.2014.01.016. Epub 2014 Feb 6.
25.van der Linden ML, Hooper JE, Cowan P, Weller BB, Mercer TH. Habitual Functional Electrical Stimulation Therapy Improves Gait Kinematics and Walking Performance, but Not Patient-Reported Functional Outcomes, of People with Multiple Sclerosis who Present with Foot-Drop. PLOS ONE 2014: 9(8): e103368. doi:10.1371/journal.pone.0103368
26. Miller L, Rafferty D, Paul L, Mattison P. The impact of walking speed on the effects of functional electrical stimulation for foot drop in people with multiple sclerosis. Disabil Rehabil Assist Technol. 2014 Mar 31:1-6. [Epub ahead of print]
27. van der Linden M. (2012), Functional electrical stimulation in children and adolescents with cerebral palsy. Developmental Medicine & Child Neurology, 54: 972-972. doi:10.1111/j.1469-8749.2012.04419
28. National Institute for Health and Clinical Excellence. IPG278. Functional electrical stimulation for drop foot of central neurological origin. London: NICE, 2008
29. Street T & Singleton C(2017) A clinically meaningful training effect in walking speed using functional electrical stimulation for motor-incomplete spinal cord injury, The Journal of Spinal Cord Medicine, 41:3, 361-366, DOI: 10.1080/10790268.2017.1392106
Multi-National Studies that included Europe
30. Stein RB, Everaert DG, Thompson AK, Chong SL, Whittaker M, Robertson J, Kuether G. Long term therapeutic and orthotic effects of a foot drop stimulator on walking performance in progressive and non-progressive neurological disorders. Neurorehabil Neural Repair. 2010;24(2):152-167
Non-European Articles
31. Karabay I, Oztürk GT, Malas FU, Kara M, Tiftik T, Ersöz M, Ozçakar L. Short-Term Effects of Neuromuscular Electrical Stimulation on Muscle Architecture of the Tibialis Anterior and Gastrocnemius in Children with Cerebral Palsy: Preliminary Results of a Prospective Controlled Study. Am J Phys Med Rehabil. 2014 Nov 20. [Epub ahead of print]
32. Seifart A, Unger M, Burger M. Functional electrical stimulation to lower limb muscles after Botox in children with cerebral palsy. Pediatr Phys Ther. 2010;22:199-206.
33. Damiano DL, Prosser LA, Curatalo LA, Alter KE. Muscle plasticity and ankle control after repetitive use of a functional electrical stimulation device for foot drop in cerebral palsy. Neurorehabil Neural Repair. 2013;27(3):200-207.
34. Danino B, Khamis S, Hemo Y, Batt R, Snir E, Wientroub S, Hayek S. The efficacy of neuroprosthesis in young hemiplegic patients, measured by three different gait indices: early results. J Child Orthop. 2013;7:537–542
35. Meilahn JR. Tolerability and effectiveness of a neuroprosthesis for the treatment of footdrop in pediatric patients with hemiparetic cerebral palsy. PM R 2013;5(6):503-9.
36. Pool D, Blackmore AM, Bear N, Valentine J.Effects of short-term daily community walk aide use on children with unilateral spastic cerebral palsy. Pediatr Phys Ther. 2014;26(3):308-17.
37. Prosser LA, Curatalo LA, Alter KE, Damiano DL. Acceptability and potential effectiveness of a foot drop stimulator in children and adolescents with cerebral palsy. Dev Med Child Neurol. 2012;54(11):1044-1049.
38. El-Shamy SM, Abdelaal A. WalkAide efficacy on gait and energy expenditure in children with hemiplegic cerebral palsy: A randomized controlled trial. AM J Phys Med Reahbil. 2016 Sep; 95(9):629-
39. Carroll MK, Toelle CA Kim SH, Ambler SB, Highsmith MJ. The effect of the WalkAide functional electrical stimulation unit on gait asymmetry in a child with cerebral palsy: A case report. Technology and Innovation, Vol. 15, pp. 287–292, 2014.
40. Field-Fote EC and Roach KE. Influence of a locomotor training approach on walking speed and distance in people with chronic spinal cord injury: a randomized clinical trial. Phys Ther. 2011;91:48–60.
41. Chandrasekaran, S., Davis, J., Bersch, I., Goldberg, G., & Gorgey, A. S. (2020). Electrical stimulation and denervated muscles after spinal cord injury. Neural Regeneration Research, 15(8), 1397–1407. https://doi.org/10.4103/1673-5374.274326